- 返回首页
-
Cell 陈斯迪组首次在CD8 T 细胞中实现体内全基因组(2)
时间:2019-08-23 来源:原创/投稿/转载作者:管理员点击:
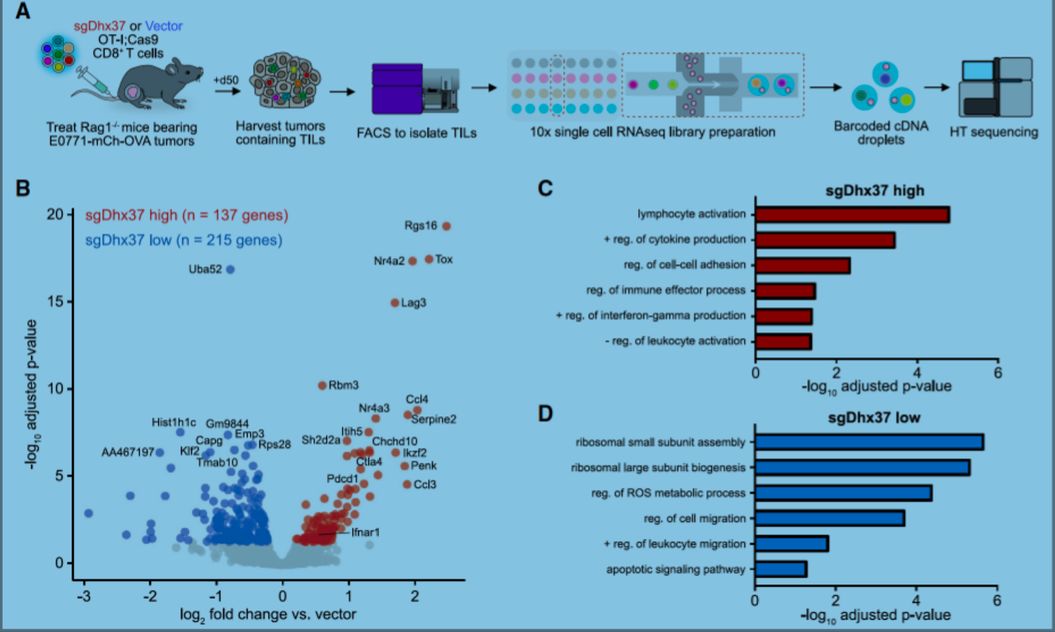
Dhx37是一种高度保守的DEAH box类RNA解旋酶,据报道,它通过释放U3 snoRNA参与小核糖体亚基的生物合成【12】。目前尚无Dhx37与T细胞功能相关的报道。作者对肿瘤浸润CD8+ T细胞进行单细胞RNA测序(scRNA-seq)与体外T细胞DHX37敲除转录表达组分析,发现免疫功能相关信号通路,包括淋巴细胞活化、细胞因子的正调节信号、免疫效应过程调节以及干扰素-γ的正调节信号,在Dhx37敲除的CD8+ T细胞中上调。作者对Dhx37敲除后上调基因启动子中的调节序列进行分析,发现最强的序列基序对应NF-kB调节基序,暗示Dhx37至少部分地通过调节NF-kB起作用。随后,免疫沉淀(IP)实验证实DHX37,PDCD11, 和NF-kB的p65组分在人CD8+ T细胞中存在相互作用。
最后,作者通过分析癌症病人中肿瘤浸润CD8+ T细胞的scRNA-seq数据,发现DHX37在耗竭T细胞(exhausted T cells)中有更高的表达。作者使用“肿瘤免疫功能障碍与排除,TIDE”分析肿瘤浸润T细胞中DHX37表达水平与乳腺癌患者的预后关系,发现虽然高水平的肿瘤T细胞浸润与病人预后良好相关,但在Luminal A型乳腺癌和三阴乳腺癌(TNBC)中,高表达的DHX37会损害或消除T细胞浸润的益处。
综上,肿瘤免疫浸润和T细胞有效杀伤是目前免疫治疗成功的关键,本文提供了通过结合体内过继性T细胞治疗的肿瘤模型和体外共培养实验,来筛选T细胞中与肿瘤免疫治疗相关基因的方法。文中揭示DHX37在耗竭T细胞中有更高的表达,机理实验暗示DHX37通过与NF-kB核心成分相互作用来调节T细胞功能,并与癌症患者的T细胞功能障碍相关的临床结果相关。敲除Dhx37可以增强T细胞的免疫杀伤能力,为临床上的肿瘤免疫治疗提供了参考。这项高通量体内T细胞筛选技术也开创了寻找潜在免疫疗法新靶点的快速通道,为发展未来更安全有效的免疫疗法铺开新途径。

该研究通讯作者为耶鲁大学Sidi Chen(陈斯迪)教授。共同第一作者为本实验室MD. PhD学生曾家宝(Matthew Dong),王广川博士、周子崴(Ryan Chow)和叶露鹏博士。
【责任编辑:管理员】
- 随机推荐 更多>>
-
- 重磅!从0上调至20%!央行祭出两
- 街头拍客自拍照相馆这样理解正确
- 【第一现场】东营一轿车不慎“跌
- 爬寨(zhài)撕(sī)罐(ɡuàn)霍(huò)是
- 兰陵王开播大典终于真相了?
- 习近平在党的十九届一中全会上的
- @所有人快来看七里河区这5个地方
- 青春期3mp4下载是这样理解吗?
- 保时捷718 T车系上市 641万起!
- 融创上半年合同销售金额21416亿元
- 江民硬盘锁这件事可以这样理解吗
- 余光中的诗为什么会上热搜?
- 美丽在望粤语发生了什么?
- “地震预警系统”刷屏了!网友:
- 台风来临 被青岛市民在外卖订单
- 1029今日美元汇率走势分析 1美元今
- 汲古润今传承创新
- 想要宝宝腿型好妈妈不懂这些可不
- A股“过山车”沪指跌003% 5G概念掀
- 【?8992晚】为遛娃而生的万豪新作
- 野村:IT目标价降至37港元 给予中
- C-HRT-Cross途铠缤智10分钟看懂谁更
- 关于坏蛋怎样炼成的电影这到底是
- 流动的永定河回来了
- 中国国家地理网
- 小学语文标点符号使用方法大全收
- 自(zì)相(xiāng)矛(máo)盾(dùn)究竟
- 苹果iPhoneX手机型号:A1865、A1901和
- 全面理解中国共产党产生的历史条
- csol大灾变Z城市是如何沦陷的?深